Este artículo centra su interés en la acidez y el pH y lo que esta supone para una planta y su entorno de cultivo. Comenzaremos repasando lo que la acidez y el pH son realmente.
¿Qué es la acidez?
La acidez es algo esencial para la vida, ya que esta suele determinar la calidad, características, capacidad de absorción y solubilidad de muchas sustancias. Así es como trabajan las encimas, responsables de la mayoría de los procesos biológicos de los organismos, pero únicamente con la acidez adecuada [1]. Una pequeña fluctuación en la acidez de la sangre puede ser mortal.
¿Qué es el pH?
El pH (pondus Hydrogenii) indica la acidez o alcalinidad de una solución [2]. El valor del pH varía, por norma general, entre 0 y 14. Una solución con un valor de pH de 0 a 7 es ácida y una con un valor de 7 a 14 es alcalina. El vinagre y la cola tienen un valor de pH inferior a 3. La soda y el jabón tienen un valor de pH superior a 8. Un valor de pH de 7 es considerado neutro. El agua pura a temperatura ambiente tiene un pH de 7. El pH del agua de grifo es generalmente superior, debido a la presencia de calcio en ella.
Muchos medios naturales como nuestra piel, los sustratos de las plantas y los medios nutritivos son ligeramente acídicos, con un pH situado entre 5 y 6.5. Si prestamos atención a las cosas que suelen gustarnos, veremos que, en general, son sustancias de acidez media o neutra, como el agua. Las plantas también prefieren sustancias levemente acídicas. Un valor de pH cercano al 5.5 es tan frecuente en la naturaleza que algunos expertos en plantas se refieren al él como 'neutro'.
El porqué de la importancia de la acidez
La acidez influye substancialmente en la capacidad de absorción y solubilidad de numerosos elementos nutritivos. (ver figura 1).
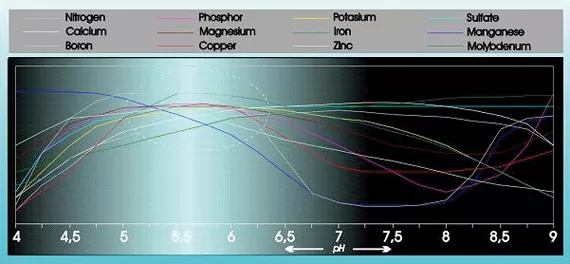
La acidez tiene además una influencia considerable en la estructura y descomposición de sustancias orgánicas, así como en la microvida del suelo. El pH también repercute en el modo en que los elementos nutritivos, metales pesados y pesticidas son eliminados del suelo.
Un valor de pH muy bajo o muy alto puede ser perjudicial para tus plantas, por lo que es importante conseguir alcanzar el valor adecuado. Pero, ¿cómo saber cuándo el pH no es el adecuado? ¡Por la experiencia! Y, para ayudarte, a continuación te describimos algunos de los síntomas que puedes observar:
Síntomas de un pH demasiado bajo (el sustrato es demasiado ácido):
- La mayoría de los nutrientes se disuelven fácilmente, lo cual puede dar lugar a un exceso de magnesio, aluminio e hierro;
- Deficiencias de fósforo, potasio, magnesio y molibdeno pueden ser causadas por un exceso de enjuague;
- Deficiencia de magnesio, especialmente en sustratos fríos;
- El suelo es pobre por lo general;
- La vida en el suelo es reducida.
Síntomas de un pH demasiado alto (el sustrato es demasiado alcalino):
- La mayoría de los nutrientes no se disuelven fácilmente, por lo que compuestos como el calcio, el hierro y el fosfato serán eliminados
- Absorción reducida de manganeso, fosfato e hierro principalmente, pero también de cobre, zinc y boro. Esto dará lugar a deficiencias, especialmente en medios de cultivo húmedos y fríos. La descomposición de sustancias orgánicas aumenta considerablemente en los suelos arenosos si el pH es alto.
¿Qué determina el pH?
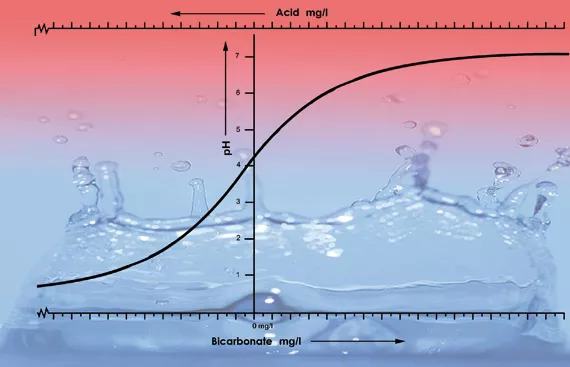
Uno de los factores más importantes para determinar el valor de pH en una solución o en el sustrato es la capacidad de amortiguación. La capacidad de amortiguación en este caso significa que existe una especie de equilibrio que se restituye continuamente asimismo. Por ejemplo, el añadir una gota de ácido a 1 litro de agua de grifo con un pH de 7 tendrá poca influencia en la acidez, sin embargo, si se añade una gota de ácido en 1 litro de agua desmineralizada (agua desionizada), el pH caerá dramáticamente. Esto ocurre porque el agua de grifo contiene bicarbonato, mientras que la desmineralizada no. El bicarbonato es el agente amortiguador más importante para los valores de pH del agua comprendidos entre 5.5 y 7.5 [4].
El bicarbonato se une al ácido en la solución, lo cual libera dióxido de carbono en la atmósfera. Es así como el ácido es neutralizado. Los cambios en la acidez no serán significativos siempre que haya bicarbonato presente.
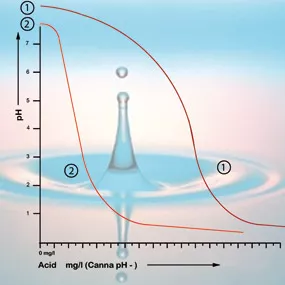
Con un pH de 5.3 el bicarbonato se habrá consumido y la solución se habrá quedado sin amortiguador. El pH será inestable y cambiará inmediatamente si se le añade ácido (ver figura 2). La cantidad de ácido que se necesita para conseguir la acidez adecuada en una solución de nutrientes puede, por lo tanto, ser calculada en base a su contenido de bicarbonato. El contenido de bicarbonato del agua de grifo es generalmente dado por la empresa del agua en miligramos por litro [5].
La capacidad de amortiguación y la acidez del sustrato dependen de su composición y frescura. La presencia de material orgánico, calcio y bicarbonato determina generalmente el pH. La arcilla siempre contiene carbonato de calcio y tiene un pH relativamente alto, lo cual no es fácil de modificar, mientras que la turba y los suelos arenosos son ácidos [6].
La planta en si misma también influye notablemente en la acidez. Las raíces segregarán sustancias ácidas o alcalinas dependiendo del estado de desarrollo de la cosecha, el alimento disponible, las diferencias en la temperatura de las raíces y la intensidad de la luz. Es por ello que el pH del entorno radicular puede fluctuar constantemente. Un sofisticado equilibrio de nutrición durante las diferentes fases de desarrollo mantendrá el pH dentro de unos límites aceptables en el entorno radicular.
La microvida, los niveles de CO2 y el crecimiento de algas, puede también tener un impacto en la acidez del entorno radicular y del tanque de nutrientes [7].
Medición del valor de pH
Es bastante fácil medir el pH –para ello necesitas algún indicador del pH como el papel tornasol o un equipo de pruebas de pH. Ambos son relativamente baratos, pero no siempre precisos, y pueden llegar a tener un margen de error de 1 o 2 unidades de pH. Los medidores de pH suelen tener un precio más elevado y su precisión dependerá del tipo de medidor y de una calibración periódica con líquido de calibración.
Tomando muestras

El pH del agua utilizada en el riego es importante, pero la acidez del entorno radicular es esencial, de modo que, para conseguir buenos resultados, es muy importante tomar bien la muestra en la que mediremos el pH. La muestra tiene que ser representativa de la acidez media del entorno radicular.
Resulta más fácil tomar muestras y medir el pH en un sistema de recirculación, basta con medir la solución de nutrientes recirculada.
En sistemas de sustratos sin recirculación, la solución de nutrientes es extraída del sustrato (lana de roca, agrofoam) en numerosos sitios. El debate entre los expertos sobre cuales son los mejores lugares para extraer las muestras lleva ya vigente algún tiempo. Nuestra recomendación, como lo es la de numerosos respetados laboratorios, es la de obtener muestras del lugar donde están las raíces, que es alrededor de y bajo los irrigadores. Toma pequeñas muestras de tantos lugares como te sea posible, y tómalas siempre en el mismo momento, preferiblemente después del segundo goteo nutritivo, durante el ciclo de luz diario.

En el suelo y los sustratos de coco y turba toma sólo una pequeña cantidad de sustrato de diferentes sitios.
Un modo de medir mejor la acidez es utilizando el 'método de extracción de proporción volumétrica 1:1.5'. Lo puedes llevar a cabo fácilmente tú mismo humedeciendo tanto el medio de cultivo que el agua se te escurra entre los dedos cuando lo aprietes fuertemente. Puedes utilizar una probeta de medición de 250 ml, llenarla hasta los 150 ml con agua desmineralizada, añadir medio de cultivo hasta que el volumen alcance los 250 ml (imagen 3), agítala bien y, tras haber dejado la mezcla reposar durante unas horas, fíltrala y mide el pH.

Valores correctos de pH para cada medio
Cuando se cultiva en sustrato, unos valores de pH situados entre 5.0 y 6.4 son buenos para el entorno radicular. No habrá ningún efecto negativo si los valores son un poco superiores o inferiores. Solo aparecerán efectos adversos inmediatos con valores inferiores a 4 y superiores a 8. Valores de pH por debajo de 4 suelen dañar las raíces. Además, los metales pesados, como el manganeso y el hierro, son tan fácilmente absorbidos que pueden llegar a envenenar la planta (necrosis). Los valores situados entre 7 y 8 no son inmediatamente dañinos para la planta, pero nutrientes como el hierro, el fosfato y el manganeso no serán tan abundantes, lo que dará lugar a deficiencias (clorosis y problemas de desarrollo) a largo plazo.
Corregir el valor del pH

Si la acidez del entorno radicular se encuentra entre 5 y 6.4, el pH del medio de cultivo está bien y no será necesario tomar ninguna medida correctiva. Intenta evitar corregir el pH a menos que sea realmente necesario, ya que será más probable que provoques un daño que una mejora; la planta siempre gusta de paz y tranquilidad. Es más importante monitorizar los cambios de acidez durante un periodo más largo. Si los valores de pH caen por debajo de 5 o aumentan por encima de 6.4, será aconsejable comenzar los ajustes gradualmente (ver figura 2)
El modo más fácil de corregir la acidez es reducir la acidez de la solución de nutrientes con ácido nítrico durante la fase de crecimiento y ácido fosfórico durante la fase de floración o, como puede ser el caso, aumentarla con potasa caustica, bicarbonato potásico o sosa [8] y CANNA RHIZOTONIC. Asegúrate de que el pH de la solución no baja demasiado de 5.0. Cuando se cultiva en lana de roca, las fibras quedan dañadas causando una gran cantidad de material alcalino que será liberado a niveles muy bajos de pH. Además, el pH es mas difícil de controlar debido a la ausencia de bicarbonato.
Un pH alto en el entorno radicular también puede ser causado por un aumento del bicarbonato. Para remediarlo, habrá que mantener el drenaje al 20% o enjuagar con una solución más ácida.
Resulta útil anotar las mediciones del pH tanto de la solución añadida como de la solución de nutrientes del sustrato. Te harás una buena idea de la progresión del pH y el efecto resultante de las medidas tomadas.
- Las enzimas proteolíticas necesitan un medio ácido (jugos gástricos) y las enzimas hidrolizadoras de carbohidratos uno alcalino (saliva).
- La acidez de una solución es determinada por el índice de iones de hidrógeno (= ácido) e iones de hidróxido (= alcalino).
- Se pueden dar carencias en los casos en que la planta tenga que segregar protones para ser capaz de absorber estas moléculas.Un medio de cultivo con un pH bajo contiene una gran cantidad de protones. Estos elementos también son eliminados en el enjuague porque los protones repelen las moléculas del medio en el sustrato.
- El bicarbonato es la sustancia que, cuando combinada con el calcio, es responsable de la aparición de la cal. En combinación con el sodio, el bicarbonato es utilizado en medicamentos para contrarrestar el exceso de ácido gástrico (Alka-seltzer).
- Algunos laboratorios también trabajan con la dureza del bicarbonato. Para traducir esto a mg/l de bicarbonato hay que multiplicar la dureza del bicarbonato por 21.8. Por ejemplo: si la dureza el bicarbonato es 11, 1 litro de agua contendrá (11x 21.8 =) 240 mg/l de bicarbonato.
Suelo arenoso: Pastizal pH 4.6 … 5.2 Terreno edificable pH 5.0 … 5.6 Arcilla: Arcilla marina pH 6.0 … 7.2 Arcilla fluvia pH 6.2 … 6.4 Turba: Sin procesar pH 4.0 - Si la presencia de algas es significativa, el pH aumentará porque el dióxido de carbono será eliminado de la solución. Las bacterias pueden transformar ciertas formas de nitrógeno, teniendo así un efecto acídico. Grandes cantidades de CO2 en el aire generan más dióxido de carbono en la solución de nutrientes y viceversa.
- Utiliza sosa sólo en pequeñas cantidades, ya que contiene sodio, y las plantas solo necesitan una cantidad muy pequeña del mismo. Recuerda que una alta concentración de sodio dañará la planta.